INLEDNING OCH SYFTE
Infektioner med Actinobacillus pleuropneumoniae (App) serotyp 2 (App2) och serotyp 3 (App3) drabbar svenska grisar främst under tillväxt- eller slaktgrisperioden, dvs från avvänjningen fram till slakt. Infektionen sprids sannolikt redan under diperioden från gyltor och suggor till de diande smågrisarna (Sjölund mfl, 2011; Vigre mfl 2002). App-bakterier finns i suggans tonsiller och sprids därifrån till de diande smågrisarna. Smågrisarna har ett visst skydd mot App genom råmjölkens antikroppar vars varaktighet är proportionerligt med antikroppsnivån i blodet hos suggan. Så länge skyddet är högre än infektionstycket förblir smågrisarna friska och avkomman till suggor med mycket antikroppar smittas därför senare än avkomman till suggor med lite antikroppar (Sjölund mfl, 2011). Vid ett lågt smittryck kan smågrisarna därefter hantera en App-infektion utan att utveckla klinisk sjukdom. En hög infektionsdos från suggan kan dock leda till sjukdomsutbrott redan under di-eller tillväxtperioden. Dessa följs ofta av såväl utbrott under slaktgrisperioden som av höga slaktanmärkningar för brösthinneärr och App har i sådana besättningar kunnat påvisas i luftstrupen hos upp till 90% av de grisarna under slutet av uppfödningen (Ehlorsson mfl, 2019). Det är dock viktigt att komma ihåg att App förekommer i de flesta besättningar, men att det vid ett lågt smittryck inte är kopplat till sjukdom eller till hög förekomst av brösthinneärr (Wallgren mfl, 1993), liksom att hög förekomst av brösthinneärr kan förekomma utan närvaro av App (Wallgren mfl, 2016). Därför är det alltid viktigt att ställa en korrekt diagnos vid hög incidens brösthinneärr.
I den nationella slaktdatabasen ses en ökande trend för registreringar av kroniska brösthinneärr för slaktgrisar, ungsuggor och suggor. Registreringarna som görs av livsmedelsverkets personal ligger idag på ca 17% (Figur 1).
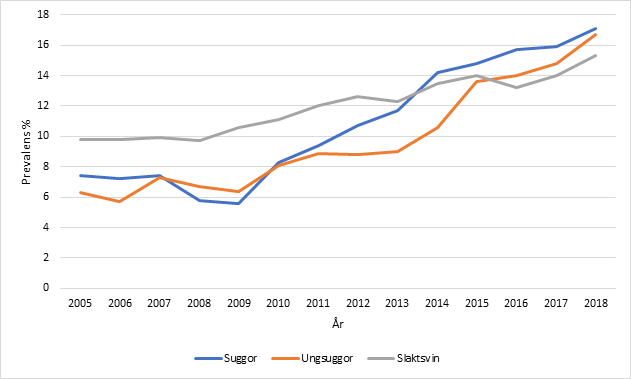
Figur 1. Andelen registreringar för brösthinneärr i samband med slakt hos slaktgrisar, ungsuggor och suggor under perioden 2005–2018 (Nationella slaktdatabasen).
Allvarliga utbrott av App-infektion innebär stort djurlidande, ökad antibiotikaanvändning och ökade kostnader. Det finns därför klart motiv för att förebygga App-infektioner. Ett sätt att åstadkomma detta är att starta en ny produktion med serogrisar, som har ett mycket högt hälsoläge och är fria från bland annat App. Ett byte till serogrisproduktion kräver dock att den egna besättningen slås ut och ersätts med serogrisar och har därför i praktiken sällan gjorts, trots att teoretiska beräkningar visat på en relativt snabb pay-back (Wallgren, 2016). Ett annat sätt är att göra en medicinsk sanering av vuxna djur, vilket innebär att alla avelsdjur flyttas och behandlas med antibiotika samtidigt som stallen töms och saneras. Även detta är mycket kostsamt, även om pay-back kan ske relativt snabbt (Wallgren, 2016; Ehlorsson och Wallgren 2018). Därutöver är det vetenskapliga underlaget för att sanera besättningar mot App begränsat. Då de flesta besättningar är endemiskt smittade med App kan ett annat sätt vara att slå ut suggor som har stor risk att smitta sin avkomma. Målsättningen med detta projekt var därför att undersöka om det går att identifiera suggor som riskerar att föra App-smittan vidare inom en besättning.
MATERIAL OCH METODER
Tre integrerade besättningar med hög incidens brösthinneärr registrerade vid slakt ingick i studien. Från de tre besättningarna skickades utslagssuggor (10 suggor/besättning) till ett slakteri för provtagning. Medelåldern på de undersökta suggorna var 3,4 kullar (median 4 kullar) i besättning 1; 5 kullar (median 5 kullar) i besättning 2 och 3,6 kullar (median 3 kullar) i besättning 3.
För att undvika kontamination av tonsillerna slaktades suggorna utan att skållas. Efter uppslaktningen togs prov med E-svabb från tonsiller och luftstrupe som analyserades med PCR-teknik avseende förekomst av influensa, App (App2 och App3), Mycoplasma hyopneumoniae (M hyop) Pasteurella multocida (Pm) och Mycoplasma hyorhinis (Gottschalk 2015, Chiers m fl 2002).
I samband med avlivningen togs 50 ml blod från varje sugga som analyserades avseende serumantikroppar riktade mot App2, App3, M hyop och Pm med indirekta ELISA-system där värden över 0,5 var positiva. Antikroppar riktade mot influensa analyserades med en blocking-ELISA där värden under 0,4 vara positiva.
Därutöver genomfördes en utökad slaktkontroll (USK) av lungorna. Vid den utökade slaktkontrollen undersöktes lungorna noggrant efter ett speciellt schema där alla förändringar, även små, noterades. Noteringarna omfattade mykoplasmaliknande förändringar i främre delen av lungorna samt App-liknande förändringar i bakre delen av lungorna. Dessutom sammanställdes slaktdata från besättningarnas slaktgrisar.
Besättning 1
Besättning 1 hade ca 450 suggor i produktion och alla grisarna föddes upp till slakt på annan fastighet i ett extern-integrerat system. Produktionen bedrevs omgångsvis i ett 3-veckors system där suggorna grisade in i en tömd och rengjord grisningsavdelning. Alla diande smågrisar vaccinerades mot PMWS och mykoplasma (Suvaxyn PCV Mhyo RTU, Orion Pharma AH, Espoo, Finland). Smågrisarna avvandes vid 28 dagars ålder och flyttades kullvis till en tömd och rengjord tillväxtavdelning. Tillväxtgrisarna vaccinerades 4 veckor efter avvänjningen en gång mot App (Suivac APP vet, Chemvet dk A/S, Silkeborg, Danmark) och efter ca 6 veckor flyttades de till en tömd och rengjord avdelning i slaktgrisbesättningen.
Besättningen var sluten med egen rekrytering av gyltor genom alternerande återkorsning. Rekryteringsdjuren vaccinerades mot influensa (Respiporc Flu 3, IDT Biologica Gmbh, Tyskland) under uppfödningen. Rekryteringsprocenten var 52 % under 2018/2019. Suggor och gyltor revaccinerades före grisningen mot App. Gyltorna revaccinerades dessutom mot influensa. Inga behandlingar för luftvägsinfektioner av gyltor/suggor registrerades under de första kvartalen 2019.
Besättning 2
Besättning 2 hade ca 450 suggor i produktion och de flesta smågrisarna föddes upp till slakt på samma fastighet och överskottet av smågrisar förmedlades. Produktionen bedrevs omgångsvis i ett 3-veckors system där suggorna grisade in i en tömd och rengjord grisningsavdelning. Alla diande smågrisar vaccinerades mot PMWS (Porcilis PCV ID, Boxmeer, Intervet, Nederländerna). Smågrisarna vandes av vid 32 dagars ålder och flyttades till en tömd och rengjord tillväxtavdelning. Efter ca 6 veckor flyttades grisarna till en tömd och rengjord slaktgrisavdelning.
Besättningen var sluten med egen rekrytering av gyltor genom alternerande återkorsning. Dessa vaccinerades mot mykoplasma (ThoroVAX, Intervet, Boxmeer, Nederländerna) och App (Suivac APP vet) under uppfödningen. Rekryteringsprocenten var 47 % under 2018/2019. Gyltorna revaccinerades mot mykoplasma före betäckningen och före grisningen mot App. Inga behandlingar för luftvägsinfektioner på gyltor/suggor registrerades under de första kvartalen 2019.
Besättning 3
Besättning 3 hade ca 900 suggor i produktion och förmedlade alla smågrisar till en slaktgrisuppfödare i ett extern-integrerat system. Produktionen bedrevs omgångsvis i ett 1-veckas system där suggorna grisade in i en tömd och rengjord grisningsavdelning. Alla diande smågrisar vaccinerades mot PMWS (Porcilis PCV ID). Smågrisarna vandes av vid 32 dagars ålder och flyttades kullvis till en tömd och rengjord tillväxtavdelning. Efter ca 6 veckor skickades de till en tömd och rengjord slaktgrisavdelning.
Besättningen var sluten med egen rekrytering av gyltor genom alternerande återkorsning. Gyltorna vaccinerades mot mykoplasma (Stellamune One, Elanco, Sligo, Irland) och App (Suivac APP vet). Suggor och gyltor revaccinerades mot App före grisningen. Rekryteringsprocenten var 59 % under 2018/2019. Inga behandlingar för luftvägsinfektioner på gyltor/suggor under de första kvartalen 2019.
Tabell 1. Storlek och system samt vaccinationsrutiner i 3 olika gårdar med hög andel brösthinneärr registrerade vid slakt
| Besättning 1 | Besättning 2 | Besättning 3 | |
| Antal suggor i produktion | 450 | 450 | 900 |
| Besättningstyp | externintegrerad | integrerad | externintegrerad |
| Grisningsintervall | 3 veckor | 3 veckor | 1 vecka |
| Tomtid inför grisning | 5 dagar | 5 dagar | 14 dagar |
| Tomtid i tillväxtavdelning | 4 dagar | 7 dagar | 7 dagar |
| Rekryteringsdjur, ursprung | egen rekrytering | egen rekrytering | egen rekrytering |
| Rekrytering under 2018/2019 | 52 % | 47 % | 59 % |
| Vaccination av gyltor | Influensa
App |
App
M hyop |
App
M hyop |
|
Vaccination inför grisning |
App
|
App |
App |
Statistik
Serologiska medelvärden jämfördes med hjälp av t-tester (heterostatiska tvåsampletester med olika varians) och slaktskadestatistik jämfördes med χ2-tester.
RESULTAT
Serologi och PCR
Totalt var 15 av 30 suggor (50 %) seropositiva mot App2 och 13 (43 %) mot App3. App påvisades i tonsillerna hos 25 av de 30 suggorna (83 %). App påvisades inte i luftstrupen hos någon av suggorna (0 %).
Vad gäller Mycoplasma hyopneumoniae (M hyop) var 25 av 30 suggor seropositiva (83 %). M hyop påvisades i tonsillerna hos 2 av de 30 suggorna (7 %) och hos dessa båda suggor påvisades M hyop även i luftstrupen. Totalt påvisades M hyop i luftstrupen hos 4 av suggorna (14 %).
Vad gäller Pasteurella multocida (Pm) så var 15 av 30 suggor seropositiva (50 %). Pm påvisades i tonsillerna hos 23 av de 30 suggorna (77 %) och hos 2 av dessa 23 suggor (9 %) påvisades Pm även i luftstrupen. Pm påvisades inte i luftstrupen hos någon annan sugga.
Avseende influensa så var 21 av 30 suggor seropositiva (70%), men influensa påvisades inte i tonsiller eller luftstrupe hos någon av dem (0 %).
Totalt påvisades Mycoplasma hyorhinis hos 4 djur i besättning 1. M hyorhinis påvisades dock inte i luftstrupen och inte hos någon av de andra suggorna i de andra två besättningarna. Det utfördes inga undersökningar av antikroppar riktade mot M. hyorhinis.
I figur 2 visas dessa resultat på besättningsnivå och figur 3 relaterar positiva och negativa PCR-fynd av App i tonsill (oavsett serotyp) till mängden antikroppar riktade mot App2 och App3.
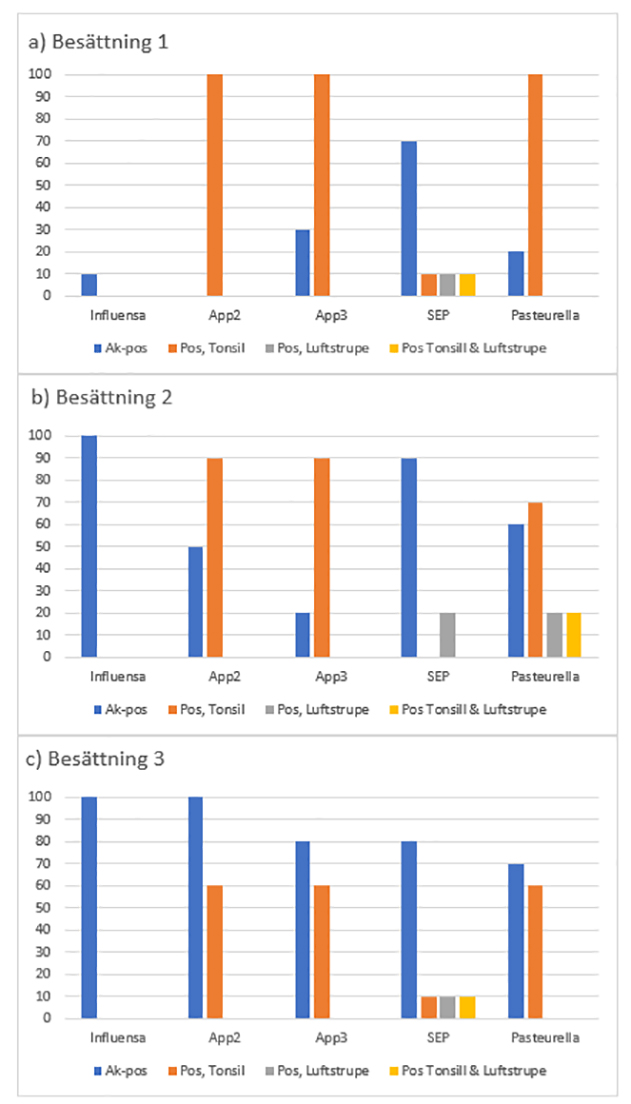
Figur 2. Andelen (%) seropositiva suggor respektive PCR-positiva suggor i tonsiller respektive luftstrupen i tre grisbesättningar med hög andel brösthinneärr registrerade på grisar vid slakt.
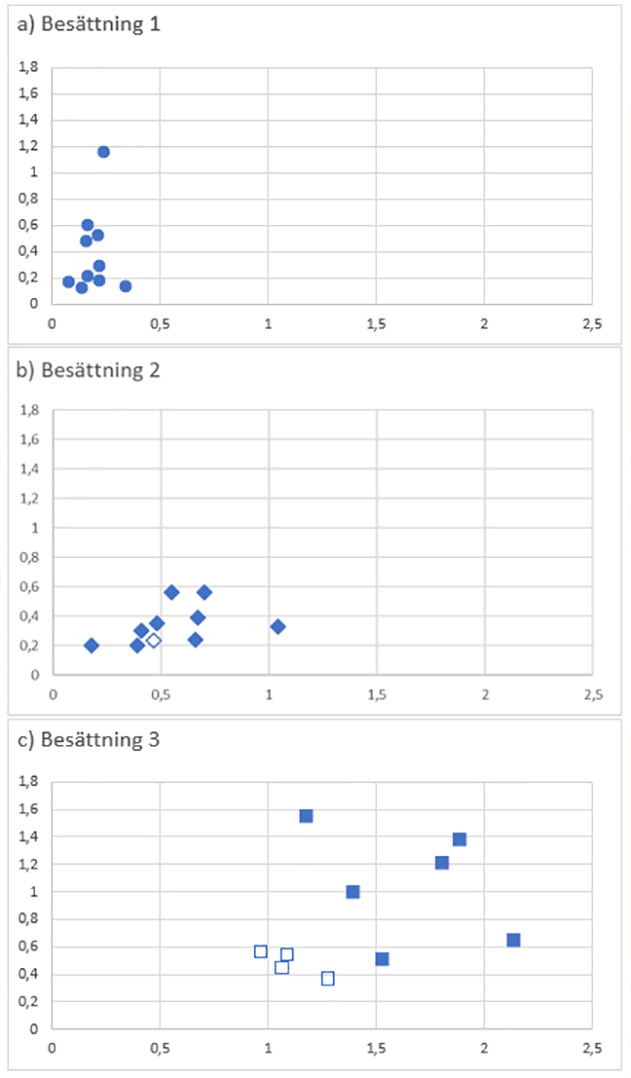
Figur 3. Absorbansnivåer (A450) mot App2 på X-axeln och App3 på Y-axeln i de tre besättningarna. Absorbansnivåer över A450 = 0,5 utgör en positiv reaktion. Fyllda symboler visar på suggor där App påvisades i tonsill. Ofyllda figurer visar djur där App inte påvisades i tonsill.
Som framgår av figur 3 var antikroppsnivåerna mot såväl App2 (p <0,001) som App3 (p <0,05–0,01) högre i besättning 3 än i de övriga besättningarna. I besättning 3 var samtliga suggor tydligt seropositiva mot App2 och endast två suggor seronegativa mot App3. App påvisades i tonsillerna från de sex suggorna med högst nivåer av antikroppar mot App2 och App3, men ej bland de fyra suggor som hade lägre antikroppsnivåer (en förstagrisare, en andragrisare och två tredjegrisare).
I besättning 2 var 8 av 10 suggor seronegativa mot App3, varav 5 även var seronegativa mot App2. Här påvisades App i tonsill hos alla suggor utom en (en fjärdegrisare). Denna sugga var seronegativ mot App3 och låg även strax under det positiva gränsvärdet för App2.
I besättning 1 där alla suggor var seronegativa mot App2 och endast tre suggor var seropositiva mot App3 påvisades App i tonsillerna hos alla 10 suggorna.
Utökad slaktkontroll (USK) och registreringar för brösthinneärr
De fynd som gjordes vid USK redovisas i tabell 2. Som framgår av tabellen registrerades inga lungförändringar alls hos två suggor per besättning. Brösthinneärr registrerades hos sju till åtta av de 10 suggorna per besättning, varav 2 till 4 hade en utbredning på över 10 % av lungfältet.
Tabell 2 visar även slaktskadestatistiken avseende brösthinneärr för besättningarna under det senaste året innan undersökningen gjordes. Besättning 2 och 3 låg över dubbla medeltalet registrerade brösthinneärr jämfört med slakteriernas medeltal. Andelen brösthinneärr skiljde sig signifikant (p <0,001, chi2-test) mellan de tre undersökta besättningarna.
Tabell 2. Resultat av den utökade slaktkontrollen (USK) samt sjukdomsregistreringar gjorda vid slakt
| Besättning 1 | Besättning 2 | Besättning 3 | |
| USK av 10 suggor | n = 10 | n = 10 | n = 10 |
| Suggor utan lunganmärkning | 2 | 2 | 2 |
| Mykoplasmaliknande förändring | 1 | – | – |
| Brösthinneärr <10% av lungfältet | 5 | 4 | 6 |
| Brösthinneärr> 10% av lungfältet | 2 | 4 | 2 |
| Slaktgrisar | n = 3 360 | n = 5 157 | n = 18 579 |
| Brösthinneärr vid slakt
Året innan undersökningen |
22,4 %
(13 – 39 %) |
41,1 %
(27 – 44 %) |
64,2 %
(58 – 71 %) |
| Slakteriernas medeltal för brösthinneärr 2019, kvartal 2 | 18,5 % | ||
DISKUSSION
Denna studie visade att App-bakterier förekom i hög utsträckning i tonsillerna hos suggor i alla tre besättningarna medan inga bakterier kunde påvisas i luftstrupen. Påvisad mängd antikroppar i blodet varierade mellan besättningarna trots likartade vaccinationsrutiner. Tydliga samband mellan förekomst av bakterier i tonsiller och hög förekomst av antikroppar i blodprov vid slakt gick därmed inte att påvisa.
Gyltorna i de tre besättningarna vaccinerades med ett avdödat vaccin som innehöll App2 som är vanligt förekommande i Sverige. Även App9 som korsreagerar med App1 och App11 ingår i vaccinet, men dessa serotyper förekommer inte i Sverige (Wallgren och Karlsson Frisch, 2018). Gyltor och suggor revaccinerades därefter inför varje grisning. Trots det var medelabsorbansen mot App2 endast 0,56 ± 0,23 i besättning 2 jämfört med 1,44 ± 0,40 i besättning 3, vilket antydde ett stort inflytande av cirkulerande App-stammar i besättning 3 med efterföljande höga antikroppsnivåer. Antikroppsnivåerna i besättning 2 antydde att vaccinationstitrar mot App2 förblir låga över tid i frånvaro eller vid låg förekomst av cirkulerande App-stammar. Även suggorna i besättning 1 hade låga antikroppsnivåer mot App2 (0,20 ± 0,07). Därför kan man inte utesluta att App-smittan bland de växande djuren i den externintegrerade besättning 1, huvudsakligen underhölls i slaktgrisbesättningen.
Trots de låga antikroppsnivåerna mot App2 och App3, de två vanligaste serotyperna i Sverige, i besättning 2 och framförallt i besättning 1 påvisades App i tonsillerna med PCR-teknik hos i princip alla suggor i dessa två besättningar, vilket bevisade att App förekom i besättningarna. Fynden skulle kunna antyda att låga antikroppsnivåer ökar risken för att App ska kolonisera tonsillerna, samtidigt som de låga antikroppsnivåerna indikerade ett lågt smittryck.
En skyddande effekt av höga antikroppsnivåer mot App skulle kunna styrkas av det faktum att App i tonsillerna påvisades hos färre djur (6 av 10) i besättning 3 som hade signifikant högre antikroppsnivåer mot såväl App2 som App3. I besättning 3 var det dock de djur som hade högst antikroppsnivåer inom besättningen som var PCR-positiva avseende App i tonsillerna, vilket visade att höga antikroppsnivåer i sig inte förhindrar förekomst av App i tonsillerna. De fyra tonsillnegativa suggorna hade signifikant (p=0,01) lägre nivåer av antikroppar mot App2 än de tonsillpositiva. En möjlig förklaring till detta skulle kunna vara att de negativa djuren ännu inte återinfekterats av de cirkulerande App-stammarna i besättning 3, men denna teori förklarar inte det faktum att dessa djur hade signifikant (p <0,001) högre antikroppsnivåer mot App2 än de tonsillpositiva grisarna i besättning 1 och 2. Antikroppsnivån hos de fyra suggorna (A450 = 1,10 ± 0,13) antydde definitivt att djuren blivit exponerade för App i närtid.
Frånvaron av behandlingar av suggor för luftvägsinfektioner, liksom frånvaron av App i luftstruparna i alla tre besättningarna indikerade snarare att suggorna i praktiken utvecklat en immunitet mot App-infektion, dvs levde i balans med smittämnet. Det skall dock noteras att det vid USK registrerades App-liknande skador hos 70–80 % av suggorna på besättningsnivå och att förekomsten av App i tonsiller var frekvent. Vi såg således inget mönster mellan antikroppsnivåer mot App och förekomst av App i tonsiller hos suggorna och identifierade därför inte någon möjlighet att särskilja smittförande suggor från icke smittförande. I praktiken bör därför alla suggor betraktas som potentiellt smittförande med App, samtidigt som skyddet från råmjölken varierar, (Sjölund mfl, 2011), liksom infektionstrycket under senare delar av uppfödningen (Wallgren mfl, 1993 och 2016).
Trots att alla djuren i besättning 2 och 3 var seropositiva mot influensa så påvisades inte influensa med PCR i någon av dessa besättningar och inte heller i besättning 1 där endast en sugga var seropositiv mot influensa. Då influensa endast utsöndras i den tidiga fasen av en infektion var detta inget oväntat resultat och kan tolkas som att influensa inte utgjorde ett problem i dessa besättningar.
En liknande bild noterades för M hyopneumoniae där minst 70 % av suggorna var seropositiva på besättningsnivå. Trots det påvisades inte M hyopneumoniae med PCR hos mer än 4 suggor som var positiva i luftstrupen varav två även i tonsillerna. Därutöver registrerades mykoplasmaliknande förändringar endast hos en av suggorna i samband med USK. Suggorna i dessa 3 besättningar föreföll därmed leva i balans med M hyopneumoniae, även om mikroben kunde påvisas i luftstrupen från suggor i alla besättningarna.
Pm påvisades i tonsillerna hos 77 % av suggorna och även i luftstrupen hos två av dessa suggor. Däremot var endast 50 % av djuren seropositiva mot Pm och inget djur hade särskilt höga antikroppsnivåer. Detta speglar att Pm finns där det finns grisar, men att suggorna i de undersökta besättningarna inte hade problem med denna sekundärpatogen.
M hyorhinis påvisades i tonsill, men inte i luftstrupen, hos 4 suggor i besättning 1 och inte alls i någon av de övriga besättningarna. M hyorhinis påvisas frekvent hos yngre grisar, men enligt denna studie i princip inte på suggor vilket även visats av andra (Clavijo mfl, 2019).
KONKLUSION
App bakterier förekom i hög utsträckning i tonsillerna hos suggorna i alla tre besättningarna men App kunde inte påvisas i luftstrupen. Vi kunde därför inte hitta något sätt att identifiera suggor som riskerar att underhålla en App-infektion i en besättning.
Eftersom App aldrig påvisades i luftstrupen hos suggor förefaller det inte finnas ett mervärde från sådana provtagningar. Hos växande djur kan däremot prov från luftstrupen ge ökad information om App-statusen i en besättning.
Resultaten visade att smittrycket avseende App-infektioner skiljer mellan besättningar och att varje besättning därmed förefaller att vara unik. Inför valet att vaccinera eller inte rekommenderas därför en provtagning för att fastställa såväl korrekt diagnos som tidpunkten för serokonvertering hos djuren. Detta för att söka optimera tidpunkten för vaccinering.
Etiskt tillstånd: C39/14
Denna studie är finansierad av Stiftelsen Svensk Grisforskning, med kompletterande medel från Gård & Djurhälsan och från SVA.
REFERENSER:
Chiers K, Donné E, Overbeke v I, Ducatelle R, Haesbrouck F. (2002). Evaluation of serology, bacteriological isolation and polymerase chain reaction for the detection of pigs carrying Actinobacillus pleuropneumoniae in the upper respiratory tract after experimental infection. Veterinary Microbiology 88 385–392.
Clavijo MJ, Davies P, Morrison R, Bruner L, Olson S, Rosey E and Rovira A (2019). Temporal patterns of colonization and infection with Mycoplasma hyorhinis in two swine production systems in the USA. Vet Microbiol. 234:110–118.
Ehlorsson C-J, Nörregård E and Wallgren P (2019). Dynamiken hos luftvägspatogener i en slaktgrisbesättning. Grisföretagaren, Nr 2; 10–12.
Ehlorsson C-J and Wallgren P (2018). Cost-benefit of eradication swine dysentery in a farrow-to-finish herd. Proc. ECPHM 10: 334 (HHM-075).
Gottschalk M (2015). The challenge of detecting herds sub-clinically infected with Actinobacillus pleuropneumoniae. The Veterinary Journal 206 30–38.
Sjölund M, Zoric M, Persson M, Karlsson G and Wallgren P (2011). Disease patterns and immune responses in the offspring to sows with high or low antibody levels to Actinobacillus pleuropneumoniae serotype 2. Res Vet Sci Aug 91 (1): 25–31.
Vigre H, Angen Ö, Barfod K, Lavritsen DT and Sörensen V (2002). Transmission of Actinobacillus pleuropneumoniae in pigs under field-like conditions: emphasis on tonsillar colonisation and passively acquired colostral antibodies. Vet Microbiolgy Oct 22; 89 (2–3): 151–9.
Wallgren P (2016). Produktionsrådgivning med inriktning att förbättre hälsoläget och minska det negativa inflytandet från infektioner, exempel gris. Komp Vet Kongr 2016:80–83.
Wallgren P, Artursson K, Fossum C and Alm GV (1993). Incidence of infections in pigs bred for slaughter revealed by elevated serum levels of interferon and development of antibodies to Mycoplasma hyopneumoniae and Actinobacillus pleuropneumoniae. J. Vet. Med. B. 40: 1–12.
Wallgren P och Karlsson Frisch K (2018). Slutsatser som kan dras av APP-inventeringen hos svenska grisar 2017. Grisföretagaren 20180618.
Wallgren P, Nörregård E, Molander B, Persson M and Ehlorsson C-J (2016). Serological patterns of Actinobacillus pleuropneumoniae, Mycoplasma hyopneumoniae, Pasteurella multocida and Streptococcus suis in pig herds affected by pleuritis. Acta Vet Scand. 2016 Oct 4;58(1):71.




